L'air est un mélange de gaz composé de :
| Azote (N 2 ) | 79,0% |
| Oxygène (O 2 ) | 20,9% |
| Gaz Carbonique (CO 2 ) | 0,03 % |
| Gaz Rares (Néon, Crypton, Argon, ...) | 0,07 % |
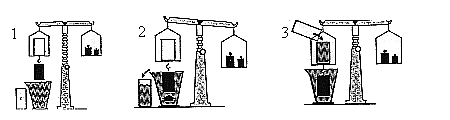
| Archimède a mesuré la force qui tend à "alléger" un corps dans l'eau et à mesurer le poids d'eau déplacé. Il en arrive donc au : |
| Théorème d'Archimède : Tout corps plongé dans un fluide reçoit, de la part de ce fluide, une poussée de bas en haut égale au poids du fluide déplacé. |
Exemple : un plongeur pèse 90 Kg équipé
pour un volume de 95 litres. Il recevra dans l'eau une poussée de
95 Kg vers le haut. Son poids apparent dans l'eau sera de -5 Kg
(il flotte). Pour pouvoir couler il devra emmener au moins 5 Kg de lest.
S'il prend 7 kg de lest, il aura un poids apparent de 2 Kg (il
coule).
Application à la plongée : Calcul de lestage, remontée
d'objets, stabilisation.
1 bar = 10 5 pascal = 14,22 PSI
Dans un fluide la pression représente le poids d'une colonne
d'eau sur sa surface.
La pression atmosphérique varie autour de 1013 mbar. L'eau pure
exerce une pression de 1 bar pour 10 mètres.
En général, en plongée on considère que
la pression atmosphérique est de 1 bar, et que la pression s'accroit
d'1 bar tous les dix mètres tel que décrit dans le tableau
suivant.
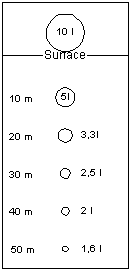
| Surface | 1 bar | 14,2 PSI | |
| 10 m | 2 bars | 33 feet | 28,5 PSI |
| 20 m | 3 bars | 66 feet | 42,7 PSI |
| 30 m | 4 bars | 100 feet | 56,9 PSI |
| 50 m | 6 bars | 164 feet | 85,3 PSI |
| 70 m | 8 bars | 230 feet | 113,8 PSI |
A température constante, le VOLUME d'un gaz est inversement proportionnel
à sa PRESSION.
L'expression mathématique complète de la loi est la suivante
:
|
|
Les applications à la plongée sont très nombreuses
: compresseur, barotraumatismes à
la remontée, surpression pulmonaire ,
consommation d'air variant selon la profondeur, ...
| Loi de Henry : A température donnée, la quantité de gaz dissous à saturation dans un liquide est proportionnelle à la pression partielle du gaz sur ce liquide. |
C'est un phénomène très important, à l'origine des phénomènes de décompression et plus tristement des accidents de décompression.
| Loi de Dalton : A température constante, la pression d'un mélange gazeux est égale à la somme des pressions qu'aurait chacun des gaz s'il occupait seul le volume total. |
| La somme des pressions partielles des gaz composant un mélange gazeux, est égale à la pression totale de ce mélange |
| Air : Azote 80%
Oxygène 20% |
|
PPN 2 |
PPO 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A titre d'information le son se propage à 1500 m/s dans l'eau
contre seulement 330 m/s dans l'air.
 Retour à la page plongée
Retour à la page plongée |
 M'envoyer un message : jbuet@iname.com
M'envoyer un message : jbuet@iname.com |
 |
|